研究紹介
|
研究内容 |
|
|
|
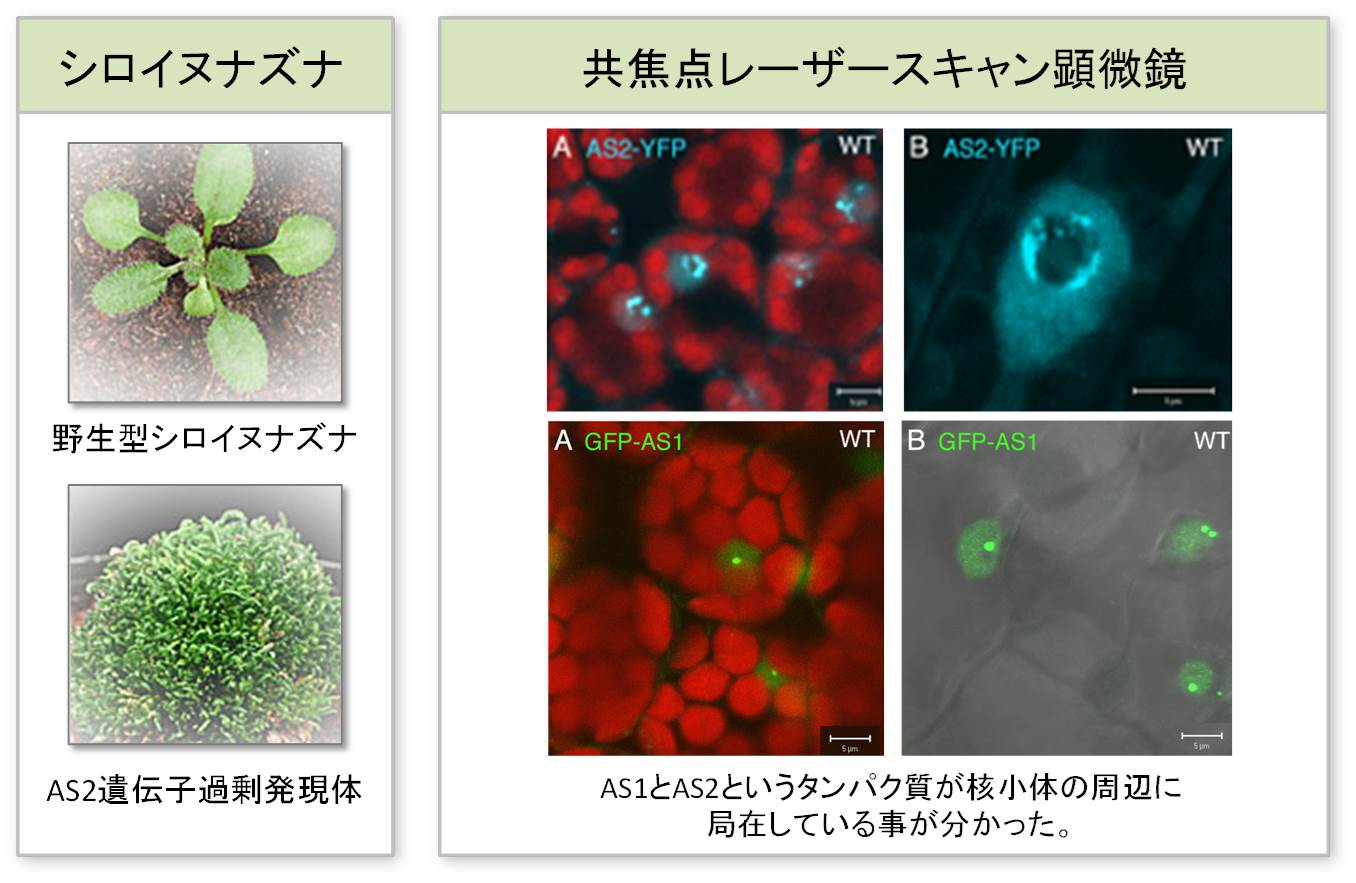
球上における植物の生育は、人間が生きる環境にとって非常に重要です。葉の初期発生分化過程においては、葉の表と裏の細胞分化の確立が重要なステップとなっています。もし、表と裏が決まらない時には扁平な葉(写真左)ができずに棒状の形(写真右)になってしまいます。 |
|
|
|
第一に「植物の葉の発生分化の分子機構の解明の研究」です。
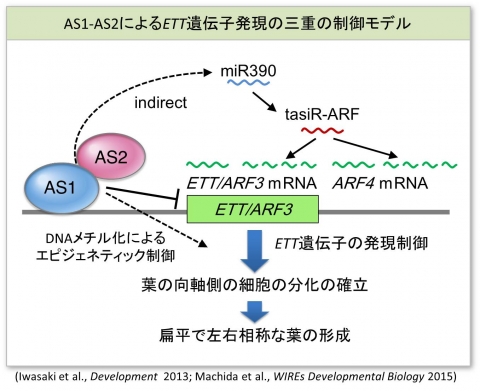
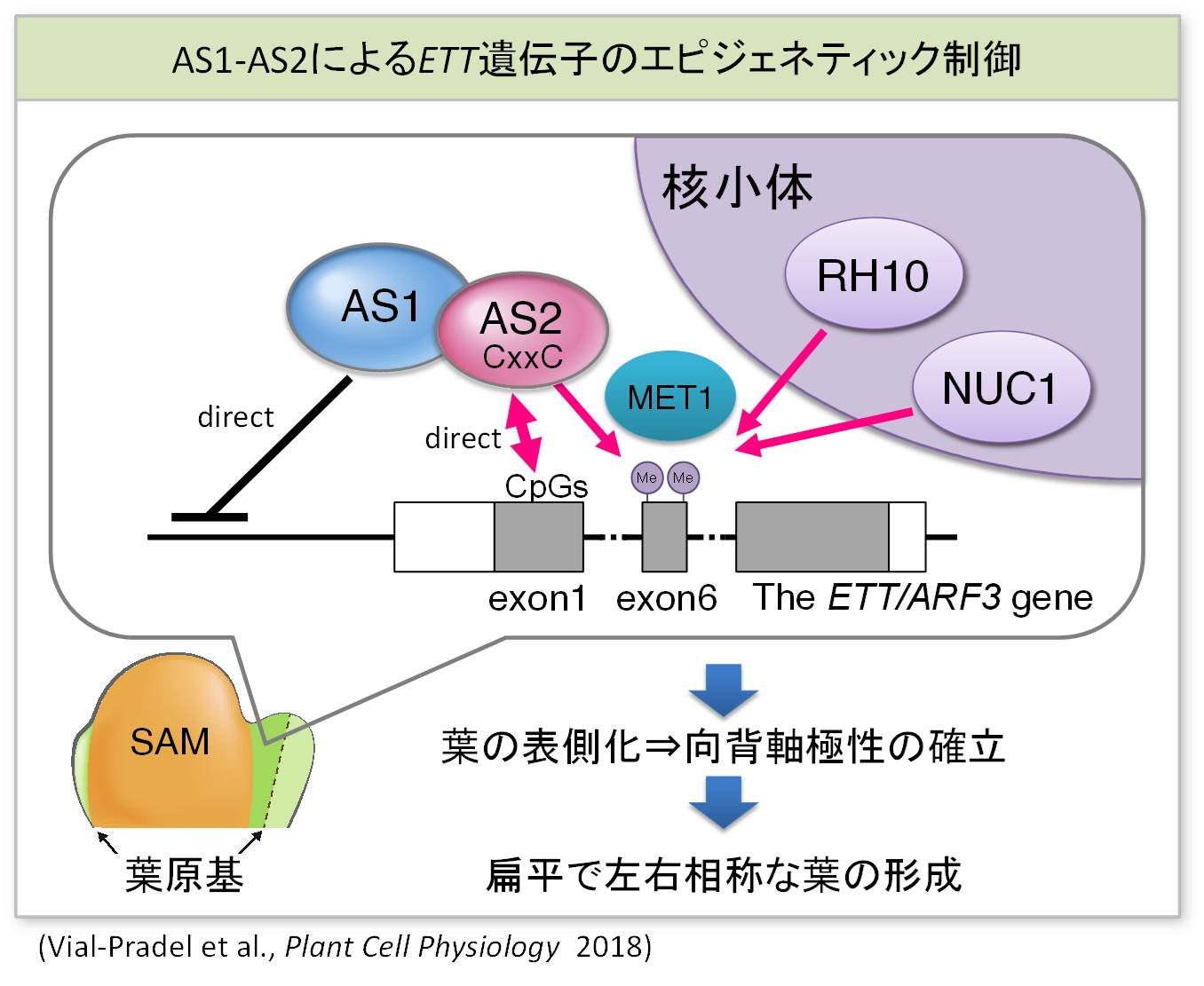
茎頂分裂組織と葉原基のどの細胞で起こっている分子反応なのか?細胞内の核のどのコンパートメントで起こっている分子反応なのか?分化から分裂へどのような細胞周期進行制御が働いているのか?を明らかにすることが今後の課題です。発生分化の過程では、エピジェネティックな制御が重要です。図に示すように私達は、AS1-AS2が葉の裏側化に関わるETT/ARF4遺伝子座のDNAメチル化を制御しいることを見いだしました。このメチル化の制御のメカニズム(下図)を明らかにすることにより、植物に特徴的な新しいエピジェネティックな制御機構が明らかになる可能性があります。
|
|
植物の葉の発生・分化の研究の紹介
|
|
Ⅰ. シロイヌナズナを用いた分子遺伝学的研究 |
|
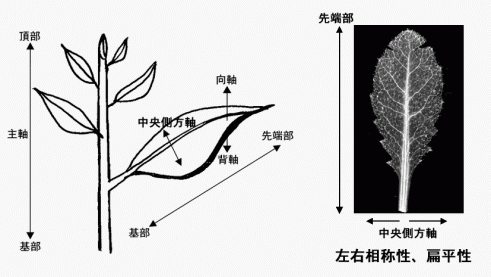
(1) 葉は茎頂メリステムからどのように発生・分化するか? |
|
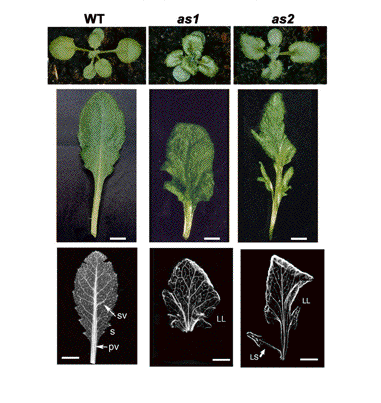
(2) 扁平で左右対称な葉の形成
図2 as1とas2変異体の表現型 |
|
植(3) 葉の裏表はどのようにしてつくられるか? |
|
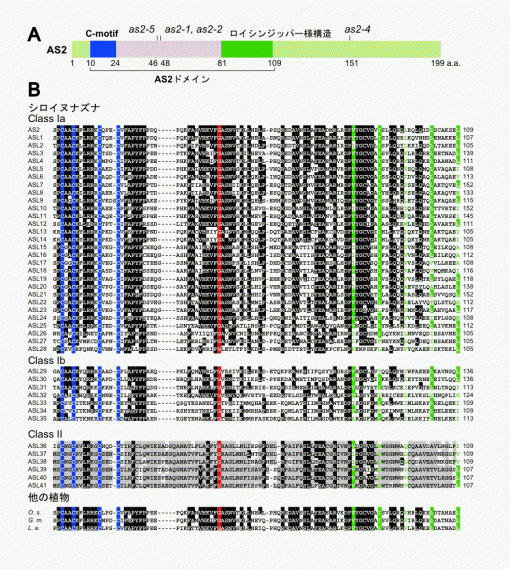
(4) AS1とAS2タンパク質の構造
図3 シロイヌナズナのAS2とイネのAS2/LOBファミリータンパク質とのアミノ酸配列の比較
シロイヌナズナのAS2とイネのAS2/LOBファミリータンパク質のAS2ドメインのアミノ酸配列の比較。イネのAS2/LOBファミリータンパク質のうち20個のメンバーを示した。このうち半分以上のタンパク質で保存されているアミノ酸残基を白抜き文字で示した。C-motifのシステイン残基を青で、ロイシンジッパー様の構造に保存されているアミノ酸残基を緑で示している。右の数字はこの位置のアミノ酸残基番号を示している。イネの場合にも、シロイヌナズナと同様に、Class Ia、Class Ib、Class IIに分類される。
図4 AS1とAS2タンパク質の構造。
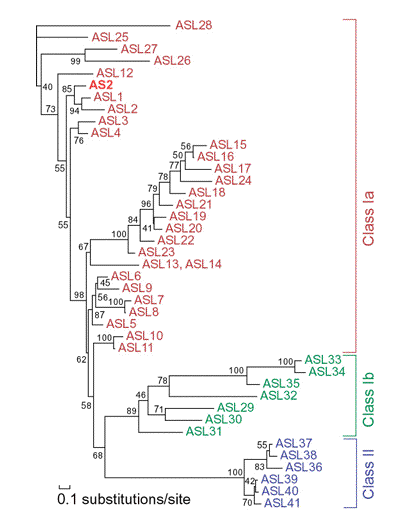
図5 シロイヌナズナのAS2及びASLタンパク質の進化系統樹。 |
|
表1. ASL蛋白質をコードするESTクローンが単離された植物 |
||
|
コケ植物 |
ヒメツリガネゴケ (Physcomitrella patens) |
|
|
シダ植物 |
ミズワラビ (Ceratopteris richardii) |
|
|
裸子植物 |
スギ (Cryptomeria japonica) |
|
|
テーダマツ (Pinus taeda) |
||
|
被子植物 |
双子葉植物 |
シロイヌナズナ (Arabidopsis thaliana) |
|
サトウダイコン (Beta vulgaris) |
||
|
キャベツ (Brassica oleraoea) |
||
|
ハクサイ (Brassica rapa) |
||
|
ピーマン (Capsicum annuum) |
||
|
スイカ (Citrullus lanatus) |
||
|
スイートオレンジ (Citrus sinensis) |
||
|
ハギクソウ (Euphorbia esula) |
||
|
キダチワタ (Gossypium arboreum) |
||
|
リクチメン (Gossypium hirsutum) |
||
|
ダイズ (Glycine max) |
||
|
ヒマワリ (Helianthus annuus) |
||
|
アサガオ (Ipomoea nil) |
||
|
レタス (Lactuca sativa) |
||
|
ミヤコグサ (Lotus japonicus) |
||
|
キバナルピナス (Lupinus luteus) |
||
|
トマト (Lycopersicon esculentum) |
||
|
タルウマゴヤシ (Medicago truncatula) |
||
|
バルサムポプラ (Populus balsamifera) |
||
|
ヨーロッパヤマナラシ (Populus tremula) |
||
|
モモ (Prunus persica) |
||
|
ニセアカシア (Robinia pseudoacacia) |
||
|
ジャガイモ (Solanum tuberosum) |
||
|
ブドウ (Vitis vinifera) |
||
|
ヒャクニチソウ (Zinnia elegans) |
||
|
単子葉植物 |
クサビコムギ (Aegilops speltoides) |
|
|
オオムギ (Hordeum vulgare) |
||
|
イネ (Oryza sativa) |
||
|
ライムギ (Secale cereale) |
||
|
モロコシ (Sorghum bicolor) |
||
|
コムギ (Triticum aestivum) |
||
|
トウモロコシ (Zea mays) |
||
|
II. コチョウランの分子遺伝学的研究 |
|
(1) コチョウランの形質転換法の開発 |
|
(2) コチョウランのclass 1 KNOXホメオボックス遺伝子の解析 |